Reni bioartificiali: gli assembloidi che portano speranza

Un gruppo di ricercatori della Keck School of Medicine della University of Southern California, guidato dal prof. Zhongwei Li, ha realizzato un significativo passo avanti nella medicina rigenerativa: ha creato in laboratorio strutture renali, chiamate assembloidi, capaci di funzioni complesse e una maturazione che supera lo stadio embrionale.
Ciò significa – almeno teoricamente – che la strada verso un rene sintetico trapiantabile si sta avvicinando. In un’epoca in cui le liste d’attesa per trapianti sono piene, la carenza di donatori è cronica, e molte malattie renali terminali si risolvono soltanto con il trapianto, ogni progresso nel campo è carico di potenziale rivoluzionario.
Cosa sono gli “assembloidi”
Prima di approfondire l’impatto, è utile capire cosa si intende con “assembloidi”:
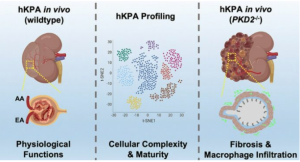
Gli studiosi partivano da organoidi: piccoli aggregati cellulari che imitano alcune caratteristiche strutturali e funzionali di tessuti/organi, come i nefroni (le unità filtranti del rene) o i dotti collettori che convogliano l’urina. Il salto in avanti consiste nell’unire due tipi di organoidi distinti per ricostruire strutture più complesse: l’“assembloide” comprende dunque sia porzioni filtranti che porzioni di raccolta/condotto.
Queste strutture sono state coltivate sia in modelli umani che murini; successivamente, trapiantate in topi vivi, hanno manifestato una “memoria naturale” cellulare che ha favorito un’ulteriore maturazione: sviluppo di vascolarizzazione (vasi sanguigni), tessuto connettivo, capacità di filtrare, assorbire proteine come l’albumina, produzione di ormoni renali, e anche segnali iniziali nella produzione di urina.
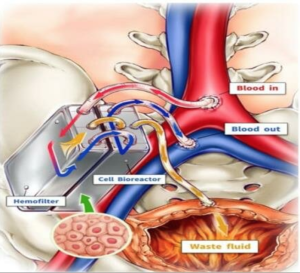
Questo risultato segna una tappa cruciale per diversi motivi:
Superamento dello stadio embrionale
Molti organoidi finora si arrestano a stadi molto immaturi, non in grado di svolgere le funzioni complesse di un rene completamente sviluppato. La maturazione che qui si è ottenuta, almeno in modello murino, li porta vicino al livello di un rene neonatale.
Funzionalità integrate
Non solo la struttura: gli assembloidi mostrano attività filtrante, produzione ormonale, assorbimento proteico. Tutto questo è essenziale, perché un rene non serve solo per “filtrare”, ma anche per mantenere l’equilibrio chimico del sangue, regolare liquidi, ormoni (es. eritropoietina) etc.
Modello per malattie renali
Oltre al sogno del trapianto, queste strutture servono come modello sperimentale per studiare malattie genetiche (il rene policistico, ad esempio), infiammazione, fibrosi, che finora erano difficili da simulare in condizioni che assomigliano realisticamente all’“in vivo”.
Potenziale riduzione del rigetto immunitario
Siccome si può immaginare di usare cellule del paziente stesso – o comunque compatibili – per generare i tessuti, il rischio di rigetto, uno dei grandi problemi nel trapianto d’organo, potrebbe essere diminuito drasticamente. Assieme, però, alle sfide tecniche che vedremo.
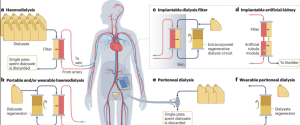
Nonostante il successo, sono molte le difficoltà da superare prima che un rene bioartificiale diventi realtà clinica:
Maturazione umana equivalente
In modello murino si è ottenuto un grado di maturazione vicino al rene neonatale di topo. Ma il rene umano è più complesso, più grande, con tempi di sviluppo più lunghi, e richiede circuiti vascolari più sofisticati. Il grado di maturazione ottenuto nei modelli umani è ancora inferiore.
Vascolarizzazione sufficiente e funzionale
Creare vasi sanguigni che non siano solo strutturali ma capaci di regolare flusso, resistere allo stress meccanico e assicurare scambi metabolici efficienti, è una pietra miliare non semplice da superare.
Connessione “fuori dal laboratorio”
Un rene “finto” deve integrarsi con il corpo umano: essere perfusato, ricevere sangue, eliminare scorie, regolare ormoni, comunicare con altri organi (per esempio la regolazione della pressione, del volume nei liquidi corporei, dell’equilibrio elettrolitico). Ogni aspetto richiede che il tessuto bioartificiale accetti funzioni sistemiche reali, sotto condizioni variabili.
Immunologia
Anche se le cellule autologhe (del paziente stesso) sono una via promettente, spesso non è possibile usarle, oppure servono cellule derivate da cellule staminali pluripotenti che devono essere “educate” a non innescare risposte immunitarie. Inoltre, la produzione su larga scala introduce la variabilità cellulare, che può tradursi in reazioni impreviste.
Lavorare con cellule staminali, strutture rigenerative, organoidi-trapiantati ha sempre implicazioni regolatorie. Servono studi preclinici e clinici rigorosi, numero alto di soggetti, comprovata assenza di tumori, possibilità di sterilizzazione/assenza di contaminazioni, stabilità nel tempo, efficacia a lungo termine.
La produzione dei bio-organi è costosa: richiede laboratori specializzati, condizioni di coltura difficili, spesso uso di bioreattori, impianti tecnologici avanzati. Perché possa diventare disponibile per molti pazienti (non solo per pochi casi-pilota), serve che i costi calino drastici.
Il contesto attuale: dove si inserisce questo studio
Questo studio sugli assembloidi non nasce nel vuoto, ma si inserisce in un panorama di intense ricerche in medicina rigenerativa, trapiantologia, genetica, bioingegneria. Ecco alcune linee di lavoro parallele e complementari:
Le malattie renali croniche
Le malattie renali croniche colpiscono una parte significativa della popolazione, spesso in modo silente fino a stadi molto avanzati. In Italia, per esempio, circa il 10% degli adulti ne è affetto, ma molti non ne sono consapevoli fino a quando non c’è già una perdita funzionale significativa.
Trapianti e donazioni in Italia
Nel 2024 l’Italia ha registrato numeri record di donatori e trapianti: 2.110 donatori d’organo, con un aumento del +2,7% rispetto all’anno precedente; e 4.692 trapianti (+5,1%) effettuati.
Tuttavia, c’è ancora resistenza culturale: oltre un terzo delle persone interpellate al momento del rinnovo della carta d’identità dice no alla donazione di organi.
Xenotrapianti e organi geneticamente modificati
Parallelamente, un’altra strada perseguita è quella degli organi animali modificati per ridurre (o ritardare) il rigetto, che potrebbe essere una soluzione “ponte” per alcuni pazienti, benché con sfide notevoli (etiche, immunologiche, virologiche).
Valutazione della qualità degli organi donati
Anche quando un rene arriva da un donatore, non tutti gli organi sono uguali: si lavora molto – anche con tecniche come perfusione normotermica o imaging avanzato – per valutare se un rene è “buono” o “marginale”, ossia se possa garantire buona funzione dopo il trapianto.
Cosa significa per i pazienti
Per i pazienti con malattia renale cronica avanzata o insufficienza renale terminale, le opzioni oggi sono:
– dialisi (emodialisi o peritoneale), che è una terapia salvavita ma con notevoli limiti: qualità della vita ridotta, visite frequenti, complicanze, costi elevati;
– trapianto da donatore umano, che è la terapia migliore in termini di efficacia, qualità della vita, ma limitata dalla disponibilità di organi e dai tempi di attesa;
– in futuro, bio-organi o organi sintetici come quello che deriverebbe da assembleoidi, se tutto va bene, potrebbero offrire:
tempi di attesa ridotti (se la produzione è accessibile);
possibilità di usare cellule compatibili, riducendo il rischio di rigetto;
miglioramento della qualità di vita eliminando la dipendenza continua dalla dialisi.
Ecco alcuni scenari possibili nei prossimi anni, e le condizioni che dovranno essere soddisfatte per far sì che i risultati diventino realtà clinica:
Progresso nella maturazione umana degli assembloidi Ottimizzazione delle colture, uso di scaffolds, fattori di crescita, ingegneria tissutale Organi che funzionano in condizioni reali, non solo in modelli animali
Sicurezza a lungo termine Studi preclinici su animali, analisi del rischio oncogeno, assenza di malformazioni, robustezza dei tessuti Permette l’avvio di sperimentazioni cliniche nell’uomo
Normative e regolamentazioni Linee guida specifiche su produzione, impianto, follow-up, standard etici Consentono l’approvazione da parte delle autorità sanitarie
Produzione su scala Automazione, riduzione dei costi, infrastrutture adeguate Evidente abbassamento del costo per paziente finale
Accettazione etica e sociale Informazione, trasparenza, coinvolgimento dei pazienti, regolamentazioni sui diritti, questioni relative alla composizione delle cellule usate Consenso pubblico, gestione delle aspettative reali
Aspetti ancora da chiarire
Mentre la sperimentazione su modello murino ha mostrato produzione di segni di urina e alcune funzioni complesse, non è chiaro se la quantità e qualità di queste funzioni siano sufficienti per sostenere un metabolismo umano completo.
– Non è chiaro quanto durino nel tempo questi bio‐organi senza perdita di funzione, senza calcificazione, senza deterioramento.
– La compatibilità immunitaria resta un problema serio, soprattutto se non si usano cellule autologhe.
– Anche il riconoscimento regolatorio richiede evidenze robuste, che devono includere dati clinici in persone, non solo in modelli animali.
Il lavoro pubblicato sugli assembloidi renali rappresenta una pietra miliare nel percorso che potrebbe portare, un giorno, alla disponibilità di organi sintetici trapiantabili. È un passo avanti molto promettente, ma non è (ancora) la risposta definitiva per la carenza di organi, né la garanzia che avremo presto reni bioartificiali pronti per l’impianto umano.
Ci vorranno anni di studio, sviluppo, prove cliniche, investimento e collaborazione interdisciplinare (bioingegneria, biologia cellulare, immunologia, etica, regolamentazione). Ma la traiettoria è chiara: la scienza mostra che rendere “vera” la promessa di un rene coltivato in laboratorio non è più fantascienza. È qualcosa che può diventare medicina.
© RIPRODUZIONE RISERVATA