“PI31”, la proteina che può ribaltare il corso della neurodegenerazione
Una svolta nelle neuroscienze potrebbe aprire nuove strade per combattere malattie come Alzheimer, Parkinson, sclerosi laterale amiotrofica (SLA) e altri disturbi neurodegenerativi. È stata individuata una proteina, chiamata PI31, capace di intervenire direttamente nei meccanismi cellulari che portano alla disfunzione sinaptica, accumulo di proteine tossiche e morte neuronale. Studi su moscerini della frutta e topi suggeriscono che aumentare i livelli di PI31 possa arrestare, in parte invertire, alcune conseguenze della neurodegenerazione.
In questo articolo: il funzionamento molecolare di PI31, le scoperte recenti, i precedenti studi che ne hanno delineato il ruolo, le sfide e le prospettive future, e il possibile impatto terapeutico per l’uomo.
Proteine, sinapsi, rifiuti cellulari
Le cellule nervose, i neuroni, comunicano attraverso le sinapsi – piccole giunzioni che trasmettono segnali elettrici e chimici. Affinché queste comunicazioni restino efficienti, è fondamentale che le sinapsi rimangano “pulite”: che i rifiuti molecolari (proteine danneggiate, substrati tossici) vengano rimossi prima che formino aggregati.
Due sistemi intracellulari aiutano questa pulizia:
Il sistema ubiquitina‑proteasoma (UPS): le proteine danneggiate vengono etichettate con ubiquitina, poi degradate dal proteasoma 26S.
L’autofagia: un processo più ampio di “digestione” cellulare che elimina organelli danneggiati, aggregati proteici, e parti della cellula.
Quando questi sistemi falliscono, il risultato è la accumulazione di proteine mal ripiegate, danni sinaptici, disfunzione neuronale, che alla lunga conducono a neurodegenerazione.

Cosa è PI31 e come è stato scoperto
PI31 è una proteina che fino a tempi recenti era nota in letteratura scientifica come regolatore del proteasoma (Proteasomal Inhibitor 31kD), con funzioni complesse che variano a seconda del contesto cellulare. Studi del passato avevano mostrato che PI31 promuoveva l’assemblaggio del proteasoma 26S, e che mancassero versioni funzionanti del gene PI31 o delle sue proteine regolatrici erano associate a patologie negli studi su cellule animali.
Uno studio fondamentale del 2019 ha analizzato topi con knockout condizionato di PI31 in due popolazioni di neuroni: i motoneuroni spinali e le cellule di Purkinje del cervelletto. Nei topi senza PI31 queste cellule sviluppavano degenerazione assonale, perdita di sinapsi, disfunzione motoria progressiva, segni tipici di malattie neurodegenerative. Lo studio mostrava anche che la perdita di PI31 causava accumulo di proteine ubiquitinate, aggregati, segni di stress proteotossico.
Altri laboratori avevano nel frattempo indagato come PI31 si legherebbe con motori intracellulari (componenti che trasportano molecole lungo gli assoni), consentendo ai proteasomi di muoversi lungo l’assone fino alle sinapsi dove sono necessari. Se il trasporto fallisce o i proteasomi non vengono assemblati correttamente, la degradazione locale non può avvenire, e i rifiuti proteici si accumulano.

Le nuove scoperte: cosa hanno mostrato moscerini e topi
Recentemente il gruppo di Hermann Steller, presso la Rockefeller University, ha pubblicato nuovi dati che estendono il ruolo di PI31 da “necessario” a “potenzialmente terapeutico”. Ecco i punti salienti:
Aumento di PI31 nei moscerini: nei modelli in cui era simulato un danno simile a quello da Parkinson, aumentare PI31 migliorava nettamente i sintomi.
Modelli murini: anche lievi incrementi nell’espressione di PI31 nei topi sono risultati nel fermare la neurodegenerazione, preservare la funzione motoria, migliorare lo stato di salute generale. In alcuni casi, la durata della vita degli animali è stata quasi quadruplicata rispetto ai controlli con deficit.
Pulizia di proteina tau anomala: nei topi affetti da aggregati tau, tipici dell’Alzheimer, la presenza maggiore di PI31 ha aiutato a rimuovere questi aggregati, migliorando le condizioni neuronali.
Questi effetti indicano non solo che PI31 è fondamentale per la conservazione del sistema proteolitico sinaptico, ma che la sua modulazione può rigenerare, almeno in parte, funzioni compromesse.
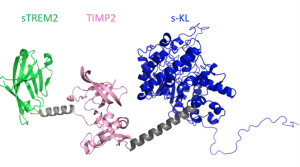
Precedenti studi che preparavano il terreno
Le ricerche più recenti non nascono dal nulla: hanno radici ben piantate in studi molecolari e genetici che, negli ultimi anni, avevano già identificato correlati del danno nei disturbi neurodegenerativi.
Mutazioni nel gene FBXO7 (noto anche come PARK15) sono collegate al Parkinson, e quel gene interagisce con PI31. Senza FBXO7 la funzione di PI31 diminuisce, il proteasoma non viene correttamente regolato, con conseguente stress proteotossico.
Studi su moscerini (Drosophila) avevano evidenziato che PI31 è necessario per il trasporto del proteasoma lungo gli assoni, per prevenire accumuli tossici nelle espansioni sinaptiche.
Il documento del 2019 (cITATO sopra) ha stabilito che l’eliminazione condizionale di PI31 in particolari tipi di neuroni causa deterioramento progressivo, collegato strettamente con la perdita di funzione motoria e con lesioni strutturali nelle sinapsi.
Questi studi avevano già suggerito: esiste un sistema di trasporto e degradazione locale dei proteasomi che è critico per la salute sinaptica; PI31 è un elemento chiave di quel sistema; quando PI31 funziona male, insorgono sintomi neurodegenerativi.
Nuovi paradigmi nella neurodegenerazione
Le scoperte su PI31 suggeriscono un cambio di paradigma su come intendiamo le malattie neurodegenerative:
Disfunzione sinaptica come causa precoce più che effetto tardivo
Le immagini cliniche spesso focalizzano sull’aggregazione di beta-amiloide, tau, alfa-sinucleina eccetera. Ma questi aggregati forse sono più un marcatore dello stadio avanzato, che la causa iniziale. Se la pulizia sinaptica fallisce, gli aggregati seguono.
L’importanza del trasporto e della localizzazione dei proteasomi
Non basta che la cellula produca proteasomi; devono essere trasportati fino alle sinapsi, assemblati correttamente, attivati localmente. Se il sistema di spedizione o assemblaggio è disturbato, la degradazione locale non avviene, e il danno si accumula.
Modulazione genica o proteica come strategia terapeutica
Invece di (o in aggiunta a) voler rimuovere gli aggregati già formati o bloccarne la formazione, potremmo puntare ad aumentare la capacità cellulare di degradarli. PI31 appare come un target promettente in questo senso.
Sfide e domande aperte
Nonostante l’entusiasmo, molti ostacoli restano:
Effetti collaterali / sicurezza: aumentare l’attività proteasomica generalizzata potrebbe avere implicazioni non previste: degradazione di proteine “utili”, disattivazione di segnali, squilibri cellulari.
Quantità e timing: in che misura PI31 deve essere aumentato, in quali tipi di neuroni, e in quale fase della malattia per essere efficace? Gli studi sugli animali suggeriscono che anche “modesti incrementi” funzionano, ma il margine terapeutico umano potrebbe essere diverso.
Cross‑specie & traduzione clinica: mentre i dati su moscerini e topi sono forti, il cervello umano è molto più complesso; la scala, la tempistica, i tipi cellulari sono diversi.
Preservare la funzione cognitiva: finora è stato dimostrato che PI31 migliora funzione motoria, sopravvivenza neuronale, riduce aggregati proteici; ma resta da verificare se preserva o migliora lo stato cognitivo nei modelli animali di Alzheimer e se questo si tradurrà nell’uomo.
Varianti genetiche umane: ci sono già mutazioni note che compromettono PI31 o geni associati. Ma nella popolazione generale, quale percentuale contribuisce al rischio? Come interagisce con altri fattori di rischio (età, stress ossidativo, proteine aggreganti, infiammazione, stile di vita)?
Prospettive terapeutiche
Alla luce di queste scoperte, si profilano alcune strategie pratiche:
Terapie geniche: usare vettori per far esprimere PI31 in neuroni vulnerabili. Potrebbe essere particolarmente utile nei casi in cui ci sono mutazioni rare che diminuiscono la funzione di PI31.
Farmaci small‑molecule / attivatori proteici: identificare molecole che aumentino la produzione di PI31, ne stabilizzino la proteina, ne migliorino la capacità di assemblaggio o trasporto dei proteasomi.
Interventi combinati: con approcci che già stanno sperimentando di ridurre aggregati proteici (anticorpi anti‑tau, anti‑beta‑amiloide, inibitori di aggregazione), ma aggiungendo PI31 per migliorare la “pulizia” locale e prevenire recidive.
Diagnosi precoce centrata su sinapsi: biomarcatori che segnalano disfunzione sinaptica, accumulo proteotossico prima che compaiano i grandi aggregati, in modo da intervenire prima.
Invecchiamento cerebrale: anche in assenza di malattia manifesto, aumentare l’efficienza dei meccanismi di degradazione proteica nei neuroni via PI31 potrebbe rallentare il declino cognitivo legato all’età.

Storie umane e remoti casi genetici
Al di là del modello animale, ci sono già segnalazioni cliniche che colleghi la funzione di PI31 a malattie neurodegenerative:
Mutazioni del gene PI31 o dei suoi regolatori (ad esempio FBXO7/PARK15) sono state identificate in persone con sintomi simili a Parkinson. Nei casi in cui la produzione del PI31 è compromessa, l’esordio può essere precoce.
In questi casi, la gravità del disturbo spesso dipende da quanta funzione residua resta al sistema (quanta proteina PI31 è espressa, quanto è efficiente il trasporto dei proteasomi).
Ci sono anche indagini su campioni post mortem che mostrano che nei cervelli di persone con Alzheimer e Parkinson si osserva ridotta attività del proteasoma nelle sinapsi, accumulo di proteine ubiquitinate, che in parte si possono correlare con dati genetici che modificano l’espressione o funzione di PI31.
La proteina PI31 emerge come una “proteina nemica della neurodegenerazione” non nel senso che attacca direttamente le proteine tossiche, ma come guardiana del sistema fisico che le smaltisce, ripristina la comunicazione tra neuroni, mantiene le sinapsi attive e pulite.
C’è ancora molta strada da fare — test clinici, verifica negli esseri umani, sviluppo di modalità terapeutiche sicure ed efficaci — ma la scoperta segna un punto di svolta, un nuovo capitolo nella lotta contro le malattie del sistema nervoso.
© RIPRODUZIONE RISERVATA